FAC-FDの原理
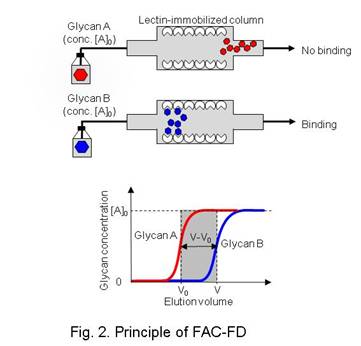
FAC-FDは定量的アフィニティークロマトグラフィーの原理に基づいています。過剰量の糖鎖溶液をレクチン固定化ゲルを充填したミニチュアカラムに供します。もし供した糖鎖と固定化レクチンの間に相互作用があれば、相互作用のない糖鎖と比較して、糖鎖が溶出する際の溶出前端(V)が遅くなります(Fig. 2)。相互作用のない糖鎖の溶出前端をV0とすると、V-V0値は糖鎖―レクチン間相互作用の結合親和性に対応します。得られたV-V0値とBt値(molで表された有効な固定化レクチン量)から、Kdは以下の公式を用いて求めることができます:
 [A]0 (V-V0)
= Bt [A]0 / ([A]0 + Kd)
(公式 1)
[A]0 (V-V0)
= Bt [A]0 / ([A]0 + Kd)
(公式 1)
この時、[A]0は使用した糖鎖の初期濃度を表します。一般的な糖鎖―レクチン間の解離定数Kd (10-3-10-7 M)と比較して、FAC-FD解析に使用する糖鎖濃度([A]0 )は5.0 x 10-9 M程度と無視できるほど低いため、公式1は以下のように変換できます:
Kd = Bt / (V-V0), if Kd >>[A]0 (公式 2)
結合定数(Ka)は、Kd (Ka =1/Kd)の逆数となります。
解析手順
FAC-FD解析は以下4つステップから構成されます。
(i)レクチン固定化カラムの調製、(ii)1次スクリーニング、(iii)2次スクリーニング、及び (iv)濃度解析
(i) レクチン固定化カラムの調製:ほとんどのレクチンカラムは、レクチンをN-hydroxysuccinimide (NHS)活性化セファロース4FFにアミンカップリング法により固定化して調製します。
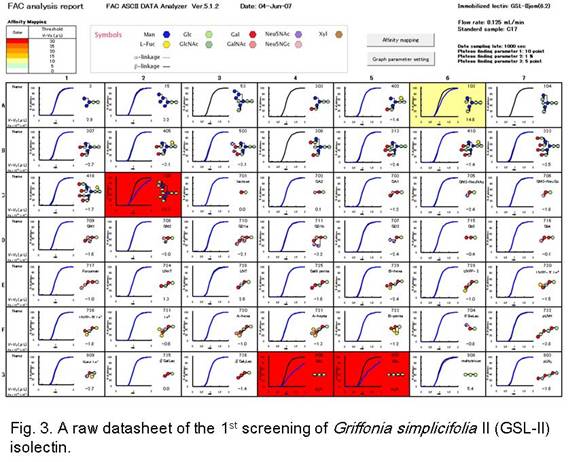 (ii) 49種のPA化糖鎖を使用した1次スクリーニング:各種複合糖質の代表的な糖鎖構造を含む49種のPA化糖鎖を用いて結合特異性を解析し、調製したレクチンカラムの検証を行います。もし、結合が見られない場合、より高濃度のレクチンカラムを調製し、再度結合活性についての検討を行います。GSL-II イソレクチンを用いた1次スクリーニングの解析例をFig. 3に示します。
(ii) 49種のPA化糖鎖を使用した1次スクリーニング:各種複合糖質の代表的な糖鎖構造を含む49種のPA化糖鎖を用いて結合特異性を解析し、調製したレクチンカラムの検証を行います。もし、結合が見られない場合、より高濃度のレクチンカラムを調製し、再度結合活性についての検討を行います。GSL-II イソレクチンを用いた1次スクリーニングの解析例をFig. 3に示します。
(iii)全PA化糖鎖を使用した2次スクリーニング:1次分析で十分な結合活性が認められた場合、全てのPA化糖鎖を使用した2次スクリーニングにより、より詳細、且つ正確な解析を行います。また必要な場合には、特定の糖鎖を使用して更に詳細な解析を行います。
(iv)濃度解析:Kd値を算出するためは有効リガンド量(Bt)を算出する必要があります。Bt値は結合性を示す適当な糖鎖誘導体を選択し、それを異なる濃度でレクチンカラムに供し、濃度依存的な結合量の変化をWoolf-Hofstee-type plotで算出します。このデータベースでは、相互作用データは結合定数(Ka)、及び実測値(V-V0)で表示しています。
